Бутан получение – Бутан получение — Найдите 3 способа получение Бутана.. Эт по химии… — 22 ответа
– это предельный углеводород, содержащий четыре атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
| Например, в молекуле бутана C4H10 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение. |

Изобутан: формула, свойства, применение.
Одним из представителей алканов является изобутан. Формула данного класса имеет вид СпН2п+2. Молекула обладает линейной структурой, в который каждый углеродный атом находится в Sp3 гибридном состоянии. Наличие в молекуле одинарных (простых) связей объясняет сходство по химическим свойствам разветвленных алканов с веществами, имеющими прямой скелет.
Какие виды изомерии имеет изобутан? Формула этого вещества – С4Н10 или (CH3)3CH. Такой же молекулярный вид имеет нормальный бутан. Следовательно, для изобутана характерна изомерия углеродного скелета (структурный вид). Межклассовых изомеров для представителей предельных углеводородов не выявлено.
Бутан: способы получения и химические свойства
Бутан C4H10 – это предельный углеводород, содержащий четыре атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.

Метан, этан, пропан, бутан и изобутан — физичесике и химические свойста


Бутан – это так называемый сжиженный природный (нефтяной) газ, который получается при перегонке нефти.
Как и пропан, бутан по своей природе является газом, но это относится не ко всем горючим газам. Бутан становится жидким при -0,5 градусах Цельсия или ниже, в то время как пропан становится жидким только при -40 градусах Цельсия. Другим большим отличием между бутаном и пропаном является давление: при температуре 20 градусов Цельсия бутан имеет давление около 1,2 бар, тогда как пропан не менее 7,0 бар.
Оба изомера бутана являются газами при комнатной температуре, потому что (n-) бутан имеет температуру плавления -138 C и температуру кипения -0,5 C, а метилпропан (изобутан) имеет температуру плавления -160 C и температуру кипения −12 °С. Бутан практически не растворим в воде (90 мг / л). Оба изомера ведут себя схожим образом: они легко воспламеняются, не обесцвечивают бромную воду и раствор перманганата калия, подвергаются воздействию только галогенов хлора и брома под воздействием света.
Структурная изомерия
Для бутана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
| Например. Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан |
| Бутан | Изобутан |
Для бутана не характерна пространственная изомерия.
– предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для бутана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для бутана характерны радикальные реакции.
Бутан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Нахождение в природе
Где встречается изобутан? Формула данного соединения, а также других представителей рассматриваемого класса свидетельствует о возможности расположения соединений в составе нефти, попутного и природного газа. Представителей этого класса СхНу называют парафинами. Разветвленные углеводороды были выделены в химической лаборатории из нефти, процесс связан с физической перегонкой этого полезного ископаемого.
Гомологический ряд бутана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Химические свойства бутана:
Бутан трудно вступает в химические реакции. В обычных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства бутана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны следующие химические реакции:
- 1. каталитическое дегидрирование бутана:
CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2 (kat = Pt, Ni, Al2O3, Cr2O3, повышенная to).
- 2. галогенирование бутана:
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CH2-CH2-CH3 + I2 → CH3-CHI-CH2-CH3 + HI (hv или повышенная to).
Реакция носит цепной характер. Молекула брома или йода под действием света распадается на радикалы, затем они атакуют молекулы бутана, отрывая у них атом водорода, в результате этого образуется свободный бутил CH3-CH·-CH3, который сталкиваются с молекулами брома (йода), разрушая их и образуя новые радикалы йода или брома:
Br2 → Br·+ Br· (hv); – инициирование реакции галогенирования;
CH3-CH2-CH2-CH3 + Br· → CH3-CH·-CH2-CH3 + HBr; – рост цепи реакции галогенирования;
CH3-CH·-CH2-CH3 + Br → CH3-CHBr-CH2-CH3 + Br·;
CH3-CH·-CH2-CH3 + Br· → CH3-CHBr-CH2-CH3; – обрыв цепи реакции галогенирования.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование бутана проходит поэтапно – за один этап замещается не более одного атома водорода.
CH3-CH2-CH2-CH3 + Br2 → CH3-CHBr-CH2-CH3 + HBr (hv или повышенная to);
CH3-CHBr-CH2-CH3 + Br2 → CH3-CBr2-CH2-CH3 + HBr (hv или повышенная to);
Галогенирование будет происходить и далее, пока не будут замещены все атомы водорода.
- 3. нитрование бутана:
См. нитрование этана.
- 4. окисление (горение) бутана:
При избытке кислорода:
2C4H10 + 13O2 → 8CO2 + 10H2O.
При нехватке кислорода вместо углекислого газа (СО2) получается оксид углерода (СО), при еще меньшем количестве кислорода выделяется мелкодисперсный углерод сажа (в различном виде, в т.ч. в виде графена, фуллерена и пр.) либо их смесь.
- 5. сульфохлорирование бутана:
C4H10 + SO2 + Cl2 → C4H9-SO2Cl + … (hv).
- 6. сульфоокисление бутана:
2C4H10 + 2SO2 + О2 → 2C4H9-SO2ОН (повышенная to).
Получение
Для лабораторного производства изобутана используют реакцию изомеризации углеводорода, имеющего неразветвленное строение. Для этого на соответствующий углеводород воздействуют активными металлами, выступающими в роли катализаторов. Таким способом в лаборатории получают и изобутан. Структурная формула данного соединения подтверждает разветвленность его строения.

Физические свойства
При нормальных условиях изобутан является газообразным веществом. При увеличении количества углеродных атомов в молекуле происходит переход к жидкому агрегатному состоянию, затем к твердому виду. Все представители алканов имеют небольшую растворимость в воде, отлично растворяются в органических соединениях.

Бутан, формула, газ, характеристики:
Бутан – органическое вещество класса алканов, состоящий из четырех атомов углерода и десяти атомов водорода. Название происходит от корня «бут-» (французское название масляной кислоты – acide butyrique) и суффикса «-ан» (что означает принадлежность к алканам).
Химическая формула бутана C4H10. Имеет два изомера н-бутан и изобутан. В химии название «бутан» используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана.
Рациональная формула н-бутана CH3-CH2-CH2-CH3, изобутана CH(CH3)3.
Строение молекулы н-бутана:
Строение молекулы изобутана:
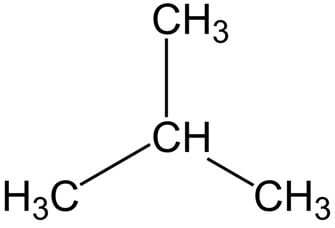
Бутан – бесцветный газ, без вкуса, со специфическим характерным запахом.
В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Для выделения из природного и попутного нефтяного газа производят их очистку и сепарацию газа.
Образуется также при крекинге нефтепродуктов., в т.ч. сланцевой нефти.
Также содержится в сланцевом газе и сжиженном газе (сжиженном природном газе).
Пожаро- и взрывоопасен.
Мало растворяется в воде и других полярных растворителях. Зато растворяется в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
Малотоксичен, но оказывает вредное воздействие на человека – на нервную систему (отравление, рвота, возможен летальный исход), обладает наркотическими свойствами, может вызвать удушье и сердечную аритмию, вызывает дисфункцию лёгочно-дыхательного аппарата. Класс опасности четвертый.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Бутан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании бутана образуется смесь хлорпроизводных.
Бромирование протекает более медленно и избирательно.
Хлорбутан может взаимодействовать с хлором и дальше с образованием дихлорбутана, трихлорбутана, тетрахлорбутана и т.д.
1.2. Нитрование бутана
Бутан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в бутане замещается на нитрогруппу NO2.
| Например. При нитровании бутана образуется преимущественно 2-нитробутана: |
В таблице приведены основные характеристики горючих газов
| с воздухом | с кислородом | ||||||||
| Газы | |||||||||
| Ацетилен | 3150-3620 | 1,173 | 52,6 | 12600 | 1 | 1,0-1,3 | 2,2-81,0 | 2,3-93,0 | Все виды газопламенной обработки |
| Бутан | 2118-2500 | 2,54 | 116 | 27800 | 0,6 | 4,0 | 1,5-8,5 | 2-45,0 | Кислородная резка, сварка и пайка цветных металлов, сварка стали толщиной до 6 мм, металлизация, правка, гибка, огневая зачистка |
| Водород | 2000-2235 | 0,09 | 10,6 | 2400 | 5,2 | 0,3-0,4 | 3,3-81,5 | 2,6-95,0 | Сварка стали толщиной до 2 мм, латуни, свинца, алюминия, чугуна, пайка, кислородная резка |
| Городской газ | 2000-2300 | 0,84-1,05 | 18,8-21 | 4400-6500 | 2,5 | 1,5-1,6 | 3,8-24,6 | 10,0-73,6 | Сварка легкоплавких металлов, пайка, кислородная и кислородно-флюсовая резка |
| Коксовый газ | 2100-2300 | 0,4-0,55 | 14,7-17,6 | 3520-4215 | 3,2 | 0,6-0,8 | 7,0-21,0 | — | Сварка легкоплавких металлов, пайка, кислородная резка |
| Метан | 2043-2200 | 0,67 | 33,4 | 8000 | 1,6 | 1,5 | 4,8-16,7 | 5,0-59,2 | Сварка легкоплавких металлов, пайка, кислородная и кислородно-флюсовая резка |
| Нефтяной газ | 2300 | 0,65-1,45 | 40,9-56,4 | 9800-13500 | 1,2 | 1,5-1,6 | 3,5-16,3 | — | Сварка легкоплавких металлов, пайка, кислородная и кислородно-флюсовая резка |
| Пиролизный газ | 2300 | 0,65-0,85 | 31,3-33,4 | 7500-8000 | 1,6 | 1,2-1,5 | — | — | Сварка стали толщиной до 2 мм, сварка латуни, свинца, алюминия, пайка, кислородная резка |
| Природный газ | 2100-2200 | 0,5-0,7 | 35,4-40 | 8500-9500 | 1,6-1,8 | 1,5-1,6 | 4,8-14,0 | 5,0-59,2 | Сварка стали толщиной до 4,5 мм, легкоплавких металлов, пайка, кислородная и кислородно-флюсовая резка |
| Пропан | 2110-2500 | 1,88 | 89 | 21200 | 0,6 | 3,5 | 2,0-9,5 | 2,0-48,0 | Кислородная резка, сварка и пайка цветных металлов, сварка стали толщиной до 6 мм, металлизация, правка, гибка, огневая зачистка |
| Пропан-бутановая смесь | 2400-2700 | 1,92 | 89 | 21200 | 0,6 | 3,0-3,5 | — | — | Кислородная резка, сварка и пайка цветных металлов, сварка стали толщиной до 6 мм, металлизация, правка, гибка, огневая зачистка |
| Сланцевый газ | 2000 | 0,7-0,9 | 12,6-14,3 | 3000-3400 | 4,0 | 0,7 | — | — | Сварка легкоплавких металлов, пайка, кислородная резка |
| Пары | |||||||||
| Бензин | 2500-2600 | 0,7-0,76 | 42-44,5 | 10000-10600 | 1,4 | 1,1-1,4 | 0,7-6,0 | 2,1-28,4 | Кислородная резка стали, сварка, пайка легкоплавких металлов, подводная резка |
| Керосин | 2400-2450 | 0,8-0,84 | 42-42,8 | 10000-10200 | 1,0-1,3 | 1,7-2,4 | 1,4-5,5 | 2,0-28,0 | Кислородная резка стали, сварка, пайка легкоплавких металлов, подводная резка |
2. Дегидрирование бутана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
| Например, п ри дегидрировании бутана преимущественно образуются бутен-2 (бутилен) или бутин-2. |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:

Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Применение
В смеси с различными пропорциями метилпропана и пропана бутан используется в качестве топливного газа («жидкий газ») для отопления и приготовления пищи в резервуарах и газовых баллонах, а также в зажигалках. Газ, содержащий бутан, служит топливом для автомобилей.
Бутан использовался в производстве бутадиена и малеиновой кислоты, а также в качестве пропеллента в аэрозолях. Оба изомера используются в качестве топливного газа в резервуарах и зажигалках, часто в смеси с пропаном.
Сжиженный газ
Основными компонентами жидкого газа являются:
- пропан: С3Н8;
- пропилен: С3Н6;
- бутан: С4Н10.
Пропан и бутан являются цепочечными, насыщенными углеводородными соединениями. Ненасыщенные углеводороды пропен и бутен имеют двойную углеродную связь. Молекулярная структура пропана и бутана относительно проста по сравнению с разветвленными цепями обычных видов топлива (бензин или дизельное топливо).
Соотношение смешивания пропана и бутана может быть различным. Поставщики газа варьируют состав в зависимости от температуры окружающей среды. Поэтому смесь может отличаться в зависимости от местоположения потребителя и времени года.
Чистые газы не имеют запаха. При необходимости в газ добавляется специальное вещество, чтобы можно было обнаружить утечку.
Использование сжиженного газа в качестве топлива для автомобилей
Газы имеют определенные недостатки по сравнению с жидкостями при заправке двигателей внутреннего сгорания. Сжиженный газ хранится в жидком виде в резервуаре, но преобразуется в газообразное состояние в испарителе на пути к двигателю и выдувается во впускной коллектор в газообразном виде.
Обычные виды топлива (бензин, дизельное топливо) обычно подают в камеру сгорания в виде мельчайших капель жидкости через карбюратор или форсунку. Поскольку плотность жидкостей намного больше, чем у газов, газообразное топливо занимает больше места во впускном коллекторе. Таким образом, газ вытесняет часть всасываемого воздуха.
Уменьшение воздуха по отношению к количеству топлива означает, что смесь становится богаче. Однако, если необходимо поддерживать постоянное соотношение воздуха, подача топлива должна быть уменьшена на соответствующую величину. Это приводит к образованию более однородной смеси с воздухом, что обеспечивает более равномерное сгорание.
Кроме того, более низкая скорость сжигания сжиженного нефтяного газа приводит к меньшим потерям тепла в двигателе, что несколько увеличивает КПД.
Бутан, получение, свойства, химические реакции.
Бутан, C4H10 – органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе. Образуется также при крекинге нефтепродуктов.
Бутан, формула, газ, характеристики
Физические свойства бутана
Химические свойства бутана
Химические реакции – уравнения получения бутана
Применение и использование бутана
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения бутана. При этом происходит удвоение углеродного скелета.
Хлорэтан взаимодействует с натрием с образованием бутана:

2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии пентаноата натрия с гидроксидом натрия при сплавлении образуются бутан и карбонат натрия:
CH3–CH2–CH2– CH2 –COONa + NaOH → CH3–CH2 – CH2 – CH3 + Na2CO3
Получение бутана. Химические реакции – уравнения получения бутана:
Так как бутан в достаточном количестве содержится в природном газе, попутном нефтяном газе и выделяется при крекинге нефтепродуктов, его не получают искусственно. Его выделяют при очистке и сепарации из природного газа, ПНГ и нефти при перегонке.
Бутан в лабораторных условиях получается в результате следующих химических реакций:
- 1. гидрирования непредельных углеводородов, например, бутена:
CH3-CH2-CH=CH2 + H2 → CH3-CH2-CH2-CH3 (kat = Ni, Pt или Pd, повышенная to).
- 2. восстановления галогеналканов:
C4H9I + HI → C4H10 + I2 (повышенная to);
C4H9Br + H2 → C4H10 + HBr.
- 3. взаимодействия галогеналканов с металлическим щелочным металлом, например, натрием (реакция Вюрца):
2C2H5Br + 2Na → CH3-CH2-CH2-CH3 + 2NaBr;
2C2H5Cl + 2Na → CH3-CH2-CH2-CH3 + 2NaCl.
Суть данной реакции в том, что две молекулы галогеналкана связываются в одну, реагируя с щелочным металлом.
- 4. щелочного плавления солей одноосновных органических кислот:
C4H9-COOH + NaOH → C4H10 + Na2CO3 (повышенная to);
C4H9-COONa + NaOH → C4H10 + NaHCO3.
3. Гидрирование алкенов и алкинов
Бутан можно получить из бутилена или бутина:

При гидрировании бутена-1 или бутена-2 образуется бутан:
При полном гидрировании бутадиена-1,3 также образуется бутан:
Эффекты и проблемы со здоровьем [ править ]
Вдыхание бутана может вызвать эйфорию , сонливость , потерю сознания , асфиксию , сердечную аритмию , колебания артериального давления и временную потерю памяти при злоупотреблении непосредственно из контейнера под высоким давлением и может привести к смерти от удушья и фибрилляции желудочков . Он попадает в кровоток и в течение нескольких секунд вызывает интоксикацию. [17] Бутан является наиболее распространенным летучим веществом в Великобритании и был причиной 52% смертей, связанных с растворителями, в 2000 году. [18]Распыляя бутан прямо в горло, струя жидкости может быстро охладиться до -20 ° C (-4 ° F) за счет расширения, вызывая длительный ларингоспазм . [19] Синдром « внезапной смерти сниффера », впервые описанный Бассом в 1970 году, [20] является наиболее частой причиной смерти, связанной с растворителями, приводя к 55% известных смертельных случаев. [19]
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
Это промышленный процесс получения алканов.
Из угарного газа и водорода можно получить бутан:
Применение и использование бутана:
– в качестве топлива в смеси с пропаном в быту для приготовления пищи, транспортных средствах, в отопительных приборах и т.п.;
– н-бутан используется как сырьё в химической и нефтехимической промышленности для получения бутилена, 1,3-бутадиена, компонентов бензинов с высоким октановым числом, для производства других химических веществ;
– в пищевой промышленности как пищевая добавка E943a и E943b (изобутан), последний используется в качестве пропеллента;
5. Получение бутана в промышленности
В промышленности бутан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы.
ли со статьей или есть что добавить?